O linfoma ou Doença de Hodgkin é um tipo de câncer que se origina no sistema linfático,...
Hematologia
As células tronco há muito são vistas como uma possibilidade médica, pelo seu potencial de diferenciação em...
A doação de sangue é muito mais segura que outrora, com diversos testes e mecanismos para evitar...
A agranulocitose, também conhecida como agranulocitopenia, é uma doença aguda do sangue, caracterizada pela redução (abaixo de...
A Glicose-6-fosfato Desidrogenase (G6PD) é uma enzima que catalisa a nicotinamide adenine dinucleotide phosphate (NADP) em sua...
Vários dias após a infecção inicial, o vírus se movimenta além do local da infecção para a...
A Sociedade Brasileira de Patologia Clínica / Medicina Laboratorial (SBPC/ML) divulgou uma nova lista de recomendações para...
O termo ICV é usado para descrever uma síndrome incompletamente definida caracterizada por uma formação prejudicada de anticorpos. Os pacientes...
O exame da alanina aminotransferase, também conhecido como ALT ou TGP, é um exame de sangue que ajuda...
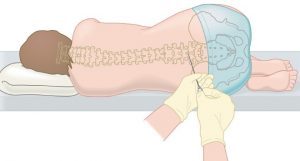
Chama-se punção lombar ao procedimento que retira uma pequena quantidade do líquor (também chamado líquido cefalorraquidiano, líquido que banha o cérebro e...